ESTUDIOS DE FUNCIONAMIENTO DE IVD
Como una Organización de Investigación por Contrato (CRO) especializada en estudios de diagnóstico in vitro (IVD), MDx proporciona servicios para estudios de funcionamiento de IVD, incluyendo estudios analíticos de funcionamiento y estudios clínicos de funcionamiento.
Los servicios de MDx están diseñados para garantizar que su producto sanitario de diagnóstico in vitro cumpla con los requisitos regulatorios de la Food and Drug Administration de los EE. UU. (FDA) y la Regulación de Diagnóstico In Vitro de la Unión Europea (IVDR), así como los estándares del Clinical and Laboratory Standards Institute (CLSI), ISO 20916, ISO 14155, y otros requisitos relevantes, incluyendo por ejemplo el programa de precalificación de la OMS.
Todos nuestros servicios incluyen soporte y consultoría en asuntos regulatorios para garantizar las solicitudes regulatorias de los estudios completas, precisas y conformes. Nuestro análisis estadístico y preparación de documentación para presentaciones regulatorias están diseñados para cumplir con los requisitos de la FDA y la IVDR.
Contáctenos hoy para obtener más información sobre cómo nuestros Estudios de IVD pueden ayudarlo a cumplir con los requisitos regulatorios y alcanzar sus objetivos de investigación.
Disciplinas Clínicas
- Química Clínica
- Hematología, Hemostasia y Transfusión de Sangre
- Microbiología, Virología, y Parasitología
- Histopatología Genética
- Y más…
Áreas Terapéuticas
- Enfermedad cardiovascular
- Medicina de precisión y Oncología
- Enfermedades infecciosas, Enfermedades respiratorias
- Trastornos neurológicos
- Rare Diseases
- Salud de la mujer
- Y más…
BIOMARCADORES, TECNOLOGÍAS Y MÁS
Con una amplia experiencia en la realización de investigaciones clínicas en una variedad de áreas terapéuticas, los servicios de MDx CRO para IVD están diseñados para ayudarle a alcanzar sus objetivos de investigación. Nuestro equipo de expertos trabajará con usted para diseñar y realizar estudios de funcionamiento clínico, gestionar y procesar muestras, y proporcionar gestión y análisis de datos.
También ofrecemos la configuración y soporte del sistema de Captura Electrónica de Datos (EDC), la gestión del Archivo Maestro de Ensayos (TMF), visitas de calificación de sitios, y monitoreo de estudios.
Descubra nuestra gama de biomarcadores, tecnologías y aplicaciones para sus estudios de IVD.
Biomarcadores IVD
- Enfermedades infecciosas
- Marcadores fisiológicos
- Marcadores de cáncer
- Diagnósticos complementarios
- Pruebas genéticas
- Autoinmunidad
- Test in-house/LDTs
- Y más…
Tecnologías y aplicaciones
- Inmunoensayos
- Next Generation Sequencing
- Multiplex
- Tecnología microfluídica
- Diagnósticos moleculares
- Pruebas cercanas al paciente
- Diagnósticos en el punto de atención
- Inmunohistoquímica
- Tecnología de flujo lateral
- Estudios en pacientes
- Software IVD

CONTACTA HOY PARA DISEÑAR EL PROYECTO QUE SE ADAPTE A LA NECESIDADES DE SUS INNOVACIONES EN DIAGNÓSTICO
SERVICIOS DE FUNCIONAMIENTO ANALÍTICO IVD
Servicios de funcionamiento analítico IVD en MDx CRO
- Diseño y desarrollo de estudios de rendimiento analítico en conformidad con los estándares técnicos de CLSI, FDA e IVDR y otros.
- Gestión y análisis de datos utilizando métodos estadísticos avanzados, asegurando la exactitud y la integridad de los datos del estudio.
- Análisis estadístico, proporcionando resultados fiables y precisos.
- Preparación de documentación y revisión de protocolos para presentaciones regulatorias, asegurando el cumplimiento de los requisitos de CLSI, FDA e IVDR.
- Consultoría sobre cumplimiento regulatorio, ayudando a los clientes a navegar por el complejo panorama regulatorio de los estudios IVD y garantizando el cumplimiento de los requisitos de CLSI, FDA e IVDR.

PREGUNTAS FRECUENTES SOBRE EL FUNCIONAMIENTO ANALÍTICO
-
¿Qué es el funcionamiento analítico de un IVD?
El funcionamiento analítico de un IVD es un componente crítico del proceso de aprobación regulatoria para los dispositivos de IVD, ya que demuestra la capacidad del dispositivo para producir resultados confiables y precisos, lo cual es esencial para garantizar la seguridad del paciente y la toma de decisiones clínicas efectivas.
La Regulación de Diagnóstico In Vitro (IVDR) de la Unión Europea y la Administración de Alimentos y Medicamentos (FDA) de los Estados Unidos requieren que los fabricantes de IVD demuestren el funcionamiento analítico de sus dispositivos como parte del proceso de presentación regulatoria.
Esto típicamente implica la realización de estudios de funcionamiento analítico para evaluar la precisión, exactitud, sensibilidad y especificidad del dispositivo, así como otras características de funcionamiento.
-
¿Cuál es la diferencia entre el funcionamiento analítico y clínico para los IVD?
El funcionamiento analítico se refiere a la capacidad de un dispositivo de IVD para medir con precisión el/los analito(s) de interés en una muestra clínica, mientras que el funcionamiento clínico se refiere a la capacidad del dispositivo para diagnosticar o predecir con precisión la presencia o ausencia de una condición médica o enfermedad específica en los pacientes.
Aunque ambos tipos de funcionamiento son importantes para la aprobación regulatoria, el funcionamiento clínico es particularmente importante para demostrar la capacidad del dispositivo para producir resultados precisos y confiables en un entorno clínico.
SERVICIOS DE FUNCIONAMIENTO CLÍNICO IVD
Servicios Clínicos IVD en MDx CRO
- Revisión del Protocolo de Estudio de Funcionamiento Clínico.
- Diseño y realización de estudios clínicos de funcionamiento de IVD, en cumplimiento con los requisitos de ISO 20916, ISO 14155, FDA e IVDR.
- Gestión y procesamiento de muestras, asegurando la más alta calidad de las muestras para resultados precisos y confiables.
- Gestión y análisis de datos, utilizando métodos y herramientas estadísticas avanzadas para garantizar resultados precisos y confiables.
- Configuración y soporte del sistema de Captura Electrónica de Datos (EDC), permitiendo una recolección y gestión de datos eficiente y segura.
- Gestión del Archivo Maestro de Ensayos (TMF), asegurando la integridad y precisión de los documentos esenciales del estudio.
- Visitas de calificación de sitios, para asegurar que los sitios de estudio cumplen con todos los requisitos regulatorios y del protocolo.
- Monitoreo del estudio, para asegurar que el estudio se realiza en cumplimiento con los requisitos de Buenas Prácticas Clínicas (GCP) y del protocolo del estudio.
- Soporte en asuntos regulatorios, para asegurar que todas las presentaciones regulatorias estén completas y precisas y cumplan con todos los requisitos regulatorios.
- Consultoría sobre cumplimiento regulatorio, proporcionando orientación sobre cómo navegar el complejo panorama regulatorio de los estudios de funcionamiento clínico de IVD.
- Análisis estadístico, proporcionando resultados confiables y precisos.
- Preparación de documentación para presentaciones regulatorias, asegurando el cumplimiento con los requisitos de la FDA y IVDR
¡Evalúe a su socio CRO de IVD hoy mismo con nuestro cuestionario a prueba de fallos!
| IVD CRO QUALIFICATION QUESTIONNAIRE | MDx |
|---|---|
| What services does the CRO provide? | |
| Clinical Operations | ✓ |
| Project Management, Medical Writing, Data Management, Statistics | ✓ |
| Regulatory Affairs | ✓ |
| Quality Assurance | ✓ |
| What devices are the CRO´s Subject Matter Experts in? | |
| Applications: Professional use, Point of Care, Self-Tests, Companion Diagnostics. All IVDR Classes. | ✓ |
| Technology: Immunoassays, NGS, Multiplex, Molecular, Lateral Flow, Microfluidic and others | ✓ |
| Therapeutic Areas: Infectious Diseases, Physiological Markers, Cancer Screening, Transfusion Medicine, Genetic Testing, Hematology, Hemostasis, Clinical Chemistry, Microbiology | ✓ |
| Software as a Medical Device/In Vitro Diagnostics | ✓ |
| Laboratory Developed Tests/ In-house developed tests | ✓ |
| Does the CRO have specific procedures for IVDs? | |
| For Clinical Operations following GCPs | ✓ |
| For Clinical Operations following GCPS, IVDR and ISO 20916 | ✓ |
| Is the CRO an Expert in the Following Regulations or Standards? | |
| GCPs | ✓ |
| GLPs | ✓ |
| IVDR | ✓ |
| ISO 20916 | ✓ |
| ISO 13485, ISO 15189 | ✓ |
| CLSI guidance, FDA requirements | ✓ |
| Where do the experts come from? | |
| IVD Notified Bodies | ✓ |
| Competent Authorities | ✓ |
| IVD Manufacturers | ✓ |
| IVD Auditors | ✓ |

PREGUNTAS FRECUENTES SOBRE EL FUNCIONAMIENTO CLÍNICO
-
¿Qué es el funcionamiento clínico de IVD?
El funcionamiento clínico de IVD se refiere a la capacidad de un dispositivo IVD para diagnosticar o predecir con precisión la presencia o ausencia de una condición médica o enfermedad específica en los pacientes.
Este es un componente crítico del proceso de aprobación regulatoria para los dispositivos IVD, ya que demuestra la capacidad del dispositivo para producir resultados confiables y precisos, lo cual es esencial para garantizar la seguridad del paciente y la toma de decisiones clínicas efectivas.
-
¿Por qué es importante el funcionamiento clínico de IVD?
El funcionamiento clínico de IVD es importante porque demuestra la capacidad del dispositivo para producir resultados confiables y precisos, lo cual es esencial para garantizar la seguridad del paciente y la toma de decisiones clínicas efectivas.
Un diagnóstico preciso y confiable es crucial para guiar el tratamiento y manejo del paciente, y los dispositivos de IVD juegan un papel clave en este proceso.
-
¿Qué factores se evalúan en los estudios de funcionamiento clínico de IVD?
Los estudios de IVD evalúan varios factores, incluyendo la sensibilidad diagnóstica, la especificidad diagnóstica, el valor predictivo positivo, el valor predictivo negativo, entre otros.
stos estudios normalmente implican la prueba del dispositivo en una población de pacientes amplia y diversa, incluyendo a aquellos con y sin la condición médica o enfermedad objetivo.
-
¿Cuáles son las principales lagunas identificadas en los estudios de funcionamiento clínico de IVD?
La principal laguna identificada en los estudios de IVD es la aplicación de fuentes para demostrar el funcionamiento clínico. A menudo hay falta de claridad y consistencia en la aplicación de fuentes de datos de funcionamiento clínico, lo que puede llevar a confusión e inconsistencias en las presentaciones regulatorias.
Los datos de funcionamiento clínico deben presentarse de una manera que sea consistente con los requisitos regulatorios, como el Anexo XIII 2.3 de la IVDR. Los estudios de funcionamiento clínico son generalmente requeridos a menos que el fabricante pueda confiar cómodamente en otras fuentes, incluyendo por ejemplo la literatura revisada por pares.
- Falta de consideración para los requisitos profesionales, cercanos al paciente y de auto-prueba: existe una falta de datos y estudios adecuadamente diseñados que respalden el funcionamiento clínico en diferentes ajustes de uso, incluyendo los ajustes profesionales, de punto de atención y de uso en el hogar.
- Datos insuficientes de funcionamiento clínico para dispositivos legados: a menudo hay datos insuficientes de funcionamiento clínico disponibles para dispositivos IVD legados, lo que puede llevar a preocupaciones sobre la fiabilidad y precisión de las pruebas diagnósticas.
- Tamaño de muestra insuficiente o población de pacientes: algunos estudios de funcionamiento clínico de IVD tienen un tamaño de muestra insuficiente o una población de pacientes insuficiente, lo que puede resultar en resultados de estudio inconclusos o poco fiables.
- Recolección o análisis de datos incompletos: los Organismos Notificados y la FDA a menudo encuentran casos en los que la recolección o análisis de datos de los estudios de funcionamiento clínico es incompleta, lo que puede llevar a resultados de estudio poco fiables o inconclusos.
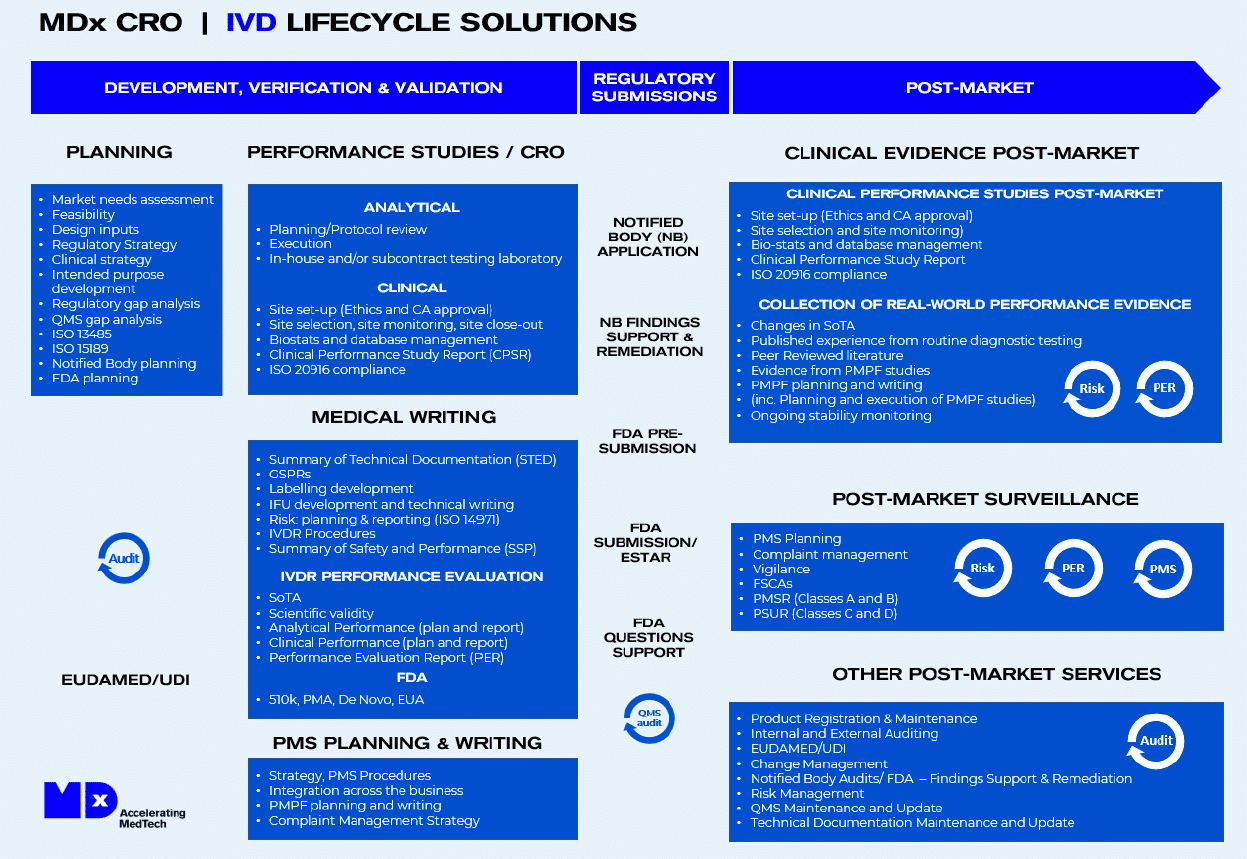
ESTUDIOS DE FUNCIONAMIENTO IVD Y SOLUCIONES DE CICLO DE VIDA CON MDX CRO
MDx CRO cubre el ciclo de vida de IVD, desde la patente hasta la comercialización y más allá. MDx entiende las complejidades involucradas en la introducción de una nueva prueba diagnóstica al mercado, y su equipo de expertos tiene la experiencia y el conocimiento para guiarle a través de cada etapa del proceso.
Ya sea que necesite ayuda con la investigación de mercado, el desarrollo de productos, la redacción médica, el cumplimiento regulatorio o el soporte post-mercado, MDx lo tiene cubierto.
MDx es su aliado durante todo el ciclo de vida del diagnóstico, apoyándole en la entrega de soluciones innovadoras y efectivas para los pacientes y los proveedores de atención médica.

MED IVD HEALTHTECH S.L ha sido beneficiaria de la subvención de contratos de trabajo de la Comunidad de Madrid, cofinanciado por el Fondo Social Europeo dentro de la Ayuda a la Recuperación para la Cohesión y los Territorios de Europa (REACT-UE), a través del Programa Operativo Regional FSE, en el marco del Programa Impulso a la Contratación Estable de Jóvenes para la Recuperación Económica, gestionado por la Dirección General del Servicio Público de empleo de la Consejería de Economía, hacienda y empleo de la Comunidad de Madrid.
© 2024 Copyright MDx | MedTech IVD CRO.
Dark mode is activated. Turn off